
技術文章
用于高通量細胞和蛋白質封裝的液滴微流體

1 簡介
液滴生成是生物醫(yī)學研究人員獲得高通量和低成本分析的強大技術[1]。利用微流體方法,科學家改進了細胞和蛋白質封裝方法。這些技術的進步為各種疾病的治療帶來了有希望的結果。本文將討論液滴生成在細胞和蛋白質封裝中的應用。我們還將向您展示充分利用實驗所需的一切。
1.1 基于液滴的微流體技術

基于液滴的微流體技術是一種通過將兩種不混溶的流體引入微流體通道來產生微小液滴的方法。通常,研究人員通過操縱通道的幾何形狀和調整連續(xù)/分散相的流速來控制液滴大小,[2]。
微尺度液滴具有更快的混合和傳熱速度,從而加快了反應時間。這些隔離室的作用類似于微反應器。此外,它們還提供物理和化學隔離的環(huán)境,以避免細胞之間的交叉污染,從而實現(xiàn)單細胞封裝、培養(yǎng)和分析[2]。
該技術具有多種優(yōu)勢,例如:
l 實現(xiàn)全細胞篩選工作流程設計
l 試劑消耗低
l 生物相容性
l 高靈敏度
液滴封裝包括多種技術。該方法因樣品的類型和數(shù)量以及所需的化學反應時間和順序而異。主要涉及將樣品稀釋到液滴的分散相中。
1.2 蛋白質封裝
微球中蛋白質的封裝是治療各種疾病的一種有前途的治療策略[1]。蛋白質療法對酶降解極為敏感。因此,將它們封裝在載體中可以在它們被輸送到體內目標部位時提供保護[3]。
獲得蛋白質納米顆粒的兩種常見策略是納米沉淀和乳化。另一種方法是乳化,然后是溶劑消耗和溶劑擴散。微流體平臺可以使該過程更高效,并提供更可控的藥物釋放速率[3]。
該技術允許研究人員根據(jù)通過水凝膠網(wǎng)絡的擴散或微凝膠水解/酶降解來定制封裝蛋白質的釋放速率[1]。
1.3 液滴中的單細胞封裝
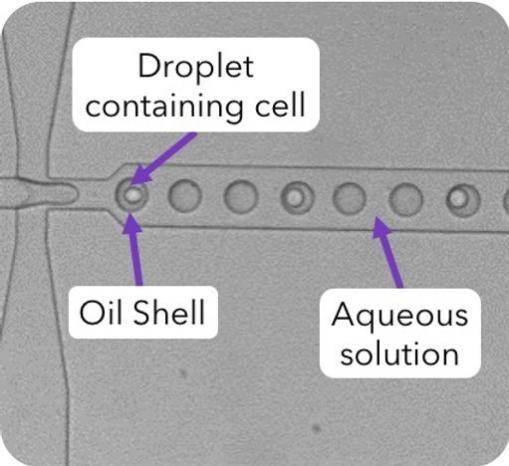
細胞微膠囊化通常使用海藻酸鹽。然而,這種材料對細胞微環(huán)境的控制有限。一種用于生成尺寸控制的合成微凝膠的微流體方法可以幫助解決這個問題。該技術可以精確控制液滴尺寸,可用于制造膜薄至 6 µm 的微凝膠[1]。
科學家可以使用微流體以高通量速率將來自人類患者和培養(yǎng)細胞系的細胞封裝在液滴中。特別是,基于液滴的單細胞技術可以帶來好處,因為它們允許研究人員在隔離的微環(huán)境中操縱單個細胞[2]。
通常,液滴包含水和細胞的溶液。然而,研究人員使用生物相容性的水凝膠或其他聚合物來保持長期細胞培養(yǎng)。值得注意的是,封裝在水凝膠液滴中的細胞可以存活一周。此外,液滴微流控平臺可以與各種分析方法相結合,包括熒光、質譜和電化學[2]。
2 應用示例
2.1. 治療性蛋白質遞送
局部植入的微凝膠可能代表一種遞送治療性蛋白質(如生長因子和細胞因子)的微創(chuàng)方式。它還可以允許包含多個微凝膠的馬賽克注射提供復雜的釋放曲線或多蛋白質遞送[1]。
2.2 移植
微凝膠中的細胞封裝有助于移植。研究人員可以控制微凝膠的大小,以減輕移植細胞的免疫浸潤,同時保持氧氣和廢物的運輸。這有助于減少移植后的免疫抑制[1]。
微凝膠還可以將細胞固定在所需的移植尺寸,這是重要的,因為許多細胞療法依賴于全身細胞給藥[1]。
合成微凝膠還可以操縱封裝干細胞的微環(huán)境,影響分化和分泌功能[1]。
2.3 高通量篩選
篩選有助于藥物發(fā)現(xiàn)、毒性和抗體親和力分析。它旨在在短時間內評估幾種化合物。液滴封裝可以改善高通量篩選結果,因為高度單分散的液滴提供了均勻的反應條件。
3 您需要什么才能開始?
液滴微流體技術提供經濟高效的高通量分析。開始液滴生成實驗的設置是:
2-3 x 微流體泵(或一臺泵上的 2-3 個通道,例如 4U 泵)——用于控制連續(xù)(油)相和分散(水)相的流動。根據(jù)應用,我們推薦 點成4U 壓力泵或 2x 點成ExiGo 微流體注射泵。點成4U 壓力泵具有穩(wěn)定而準確的流速,可獨立控制 4 個不同的通道,控制壓力和流量。您可以使用智能手機編程流量曲線并有效管理所有泵功能。
l 2 個流量傳感器,用于反饋油相和水相的流量控制。
l 具有適當幾何形狀的微流控芯片可產生液滴,以確保液滴尺寸好。
l 穩(wěn)定的通道表面化學可確保液滴穩(wěn)定性。
l 表面活性劑可穩(wěn)定油相和水相之間的界面,使液滴穩(wěn)定。
l 連續(xù)相油可提高液滴穩(wěn)定性。 管道可從您的泵連接到微流控芯片
點成可以提供完整的套件或僅提供您想要的組件。 要了解有關我們產品的更多信息,請關注我們。
引用
1. Headen, D., García, J. & García, A. Parallel droplet microfluidics for high throughput cell encapsulation and synthetic microgel generation. Microsyst Nanoeng 4, 17076 (2018).
2. Lin, Jin-Ming, ed. Microfluidics for Single-Cell Analysis. Springer, 2019.
3. Meng, Hu, et al. "The role of microfluidics in protein formulations with pre-programmed functional characteristics." Biologics: targets & therapy 12 (2018): 191.
 關注微信
關注微信